Les problèmes posés par les fonds marins
A la surface
Le facteur principal influant sur l'organisme humain en plongée est la pression exercée par l'eau, on parle alors de pression hydrostatique. Celle-ci augmente avec la profondeur : alors que nous sommes soumis à une pression d'environ 1 bar à l'air libre au niveau de la mer (pression atmosphérique), le poids de l'eau au-dessus du plongeur immergé soumet celui-ci à une pression additionnelle d'environ 1 bar tous les 10 mètres.
Le premier problème posé par la variation de pression est causé par l'air contenu dans les différentes cavités du corps (oreille moyenne, sinus, appareil respiratoire…) qui voit son volume varier de manière inversement proportionnelle à la pression ambiante, suivant la loi de Boyle-Mariotte : P1*V1=P2*V2
avec :
P1 représentant la pression initiale (en kPa ou mm Hg)
V1 représentant le volume initial (en mL ou L)
P2 représentant la pression finale (en kPa ou mm Hg)
V2 représentant le volume final (en mL ou L)
Le phénomène énoncé par la loi de Boyle-Mariotte a des conséquences très importantes pour les plongeurs. Lors d'une plongée sous-marine, on respire de l'air à la pression ambiante de la profondeur considérée. Par conséquent, lors de la remontée, l'air qui a été comprimé va se détendre et donc augmenter son volume. Donc, si on bloque sa respiration pendant la remontée, l'air contenu dans les poumons ne pouvant pas s'échapper va les distendre et provoquer la rupture des tissus : c'est la surpression pulmonaire. De la même façon, les gaz dissous sous l'effet de la pression plus élevée dans le sang et les tissus corporels vont, lors de la remontée, retourner à l'état gazeux. Les bulles ainsi créées peuvent causer des embolies. Il est donc nécessaire de respecter des paliers de décompression afin de permettre une évacuation progressive des gaz et éviter ainsi une embolie gazeuse.
Une partie du phénomène est cependant liée à la loi de Henry régissant la variation de solubilité des gaz dans un liquide selon la pression. La loi de Henry joue un rôle primordial en plongée car elle permet de déterminer la dissolution de l'azote dans l'organisme en fonction des paramètres cités ci-dessus, et plus particulièrement en fonction de la variation de pression et du temps. Ainsi, à la pression atmosphérique, les liquides de notre organisme se trouvent dans un état de saturation vis à vis des gaz composant l'air contenu dans nos poumons. Lors de la descente, vu que la pression augmente, les valeurs de saturation des gaz vont évoluer et donc les quantités de gaz dissouts dans le sang augmentent. L'organisme consomme l'oxygène dissous mais l'azote, pour sa part reste dissous dans le sang. Lors de la remontée, la pression diminue et donc l'organisme se retrouve en sursaturation. A ce moment l'azote dissous dans les tissus va tendre à retourner à l'état gazeux. Il y a alors formation de micro bulle d'azote dans le sang au niveau des organes, ces bulles étant ensuite acheminées par le sang vers les poumons et éliminées par la respiration. Ainsi quand le plongeur respecte la vitesse de remontée adéquate et les paliers de décompression, l'azote est évacué, l'organisme retrouve l'état de saturation et la remontée peut se faire en toute sécurité. A l'inverse, en cas de remontée rapide ou de non respect des paliers, la sursaturation sera trop importante et les bulles ne pourront pas être éliminées par les poumons. Ces bulles seront alors acheminées vers les différents organes et, comme la pression baisse, leur taille augmente. Ces bulles, en obstruant les vaisseaux sanguins sont l'origine des accidents de décompression.


Les bulles peuvent être présentes dans différentes parties de l’organisme en intra-vasculaire ou en extra-vasculaire. Elles peuvent provoquer différentes réactions et différents accidents dont les accidents cutanés, ostéo-articulaire, neurologique, de l’oreille interne et respiratoire.
Le deuxième problème dus aux variations anormales de pressions, sont les accidents dans les organes creux appelés barotraumatismes. Ceux-ci touchent les différentes cavités en contact avec l'air inspiré : oreilles, sinus, dents, intestin, mais aussi l'espace situé entre le masque et le visage, et la peau en contact avec une bulle d'air emprisonnée par une combinaison.
Nous allons commencer par parler de l'air contenu dans l'oreille moyenne du plongeur. Lors de la descente, celle-ci est en dépression par rapport au milieu ambiant, ce qui crée une déformation du tympan. Lors de la remontée le phénomène inverse se produit et l'oreille moyenne passe en surpression. Nous avons fait une expérience pour le démontrer avec une membrane qui modélisait le tympan dans une cloche sous vide pour représenter la plongée. L’expérience de la modélisation de l’oreille nous a montré que lorsque la pression diminue (en remontée) la membrane se gonfle et lorsqu'elle augmente (en descente), la membrane se creuse. S’il y a une différence de pression entre les deux oreilles moyennes cela peut créer des vertiges alterno-barique. L’appareil vestibulaire sert à donner au cerveau des informations concernant sa position dans l’espace. Lorsqu’il y a une pression gazeuse sur la paroi de l’appareil vestibulaire, celle-ci change les informations. S’il y a une différence de pression entre les deux oreilles moyennes, le cerveau reçoit des données contradictoires qu’il ne sait pas interpréter.
Le plongeur a donc un vertige, souvent passager (de 30 secondes à quelques minutes), qui peut entraîner des complications en cas de panique. Il perd en effet tout repère spatial, et ne peut pas dans l’eau se réorienter sur des repères visuels.
Un autre problème concerne l'air contenu dans les poumons du plongeur. Lors de la remonté il se dilate. Si le plongeur n'est pas attentif et n'expire pas ou pas assez (en cas d'apnée involontaire, de panique, de remontée trop rapide…), la surpression pulmonaire ainsi créée peut entrainer des lésions graves. Nous avons fait l’expérience du ballon dans la cloche sous vide pour modéliser les organes de l’organisme au cours de la plongée et plus particulièrement les poumons. Lorsqu’on baissait la pression, donc en remonté le ballon gonflait et lorsqu’on l’augmentait le ballon dégonflait.
Le troisième problème posé par la variation de pression, sont les aéro-embolisme qui surviennent lors de la descente. La pression sur la cage thoracique augmente, amplifiant la pression des gaz dans les poumons et dès lors la pression des gaz dissous dans le sang (le dioxygène (O2), le dioxyde de carbone (CO2), mais aussi et surtout l’azote (N2)). Si la remontée est trop rapide en fin de plongée, l’azote est brutalement libéré dans le sang à l'état gazeux. Il y a alors formation dans le sang de bulles gazeuses qui provoquent des troubles circulatoires aux conséquences variées, parfois très graves (coma irréversible). Ce phénomène est dû à la brusque évaporation des gaz dissous dans le sang, qui se produit à l'occasion de décompressions brutales telles qu'il s'en produit au cours de la remontée trop rapide des plongeurs.
En cours de plongée, un plongeur respire de l'air ambiant comprimé, et donc un mélange de plusieurs gaz. La loi de Dalton établit une série de règles qui régissent ces mélanges gazeux. Ces règles sont essentielles car à partir d'une certaine profondeur, chacun des gaz qui composent l'air devient toxique pour l'organisme et peut entrainer des accidents biochimiques. La tolérance de l'organisme à divers gaz varie selon leur nature et la pression à laquelle ils sont respirés. En conséquence la loi de Dalton est utilisée pour calculer la profondeur limite de plongée, la mise au point des tables de plongée et la préparation des mélanges gazeux.
Gaz impliqué
Oxygène
Azote
CO2
Nom
Pression partielle seuil (PP)
Profondeur seuil
Hyperoxie PP > 1.6 bars
Narcose PP > 3.2 bars
Essoufflement PP > 0.02 bar
70 mètres
30 mètres
suivant effort
Sous l'eau, les réflexes respiratoires sont modifiés: en effet, à la surface, l'inspiration et l'expiration sont des automatismes. Sous l'eau, le travail respiratoire est plus difficile en raison de la pression qui va appliquer un effort sur la cage thoracique du plongeur qui doit alors forcer la respiration et qui devient volontaire. Le mécanisme complexe qui a lieu au sein de l'alvéole est modifié, le dioxyde de carbone (CO2) devient plus difficile à évacuer, le risque d'essoufflement devient important.
Comme vu précedemment, lle dioxygène, pourtant indispensable à la survie du plongeur, devient toxique avec l'augmentation de sa pression partielle. Cet effet nommé hyperoxie est dû à la toxicité neurologique du dioxygène à partir d'une pression partielle de 1,6 bar. Il soumet le plongeur à un risque de crise hyperoxique (effet Paul Bert) et donc de perte de connaissance conduisant à la noyade. D'autre part, une exposition prolongée à une pression partielle d'O2 de plus de 0,6 bar peut provoquer des lésions pulmonaires de type inflammatoire (effet Lorrain Smith).
Il existe également une intoxication au dioxyde de carbone appelée « essoufflement ». Elle peut survenir si la ventilation n'est pas suffisante, c'est pourquoi le plongeur évite tout effort (palmage vigoureux…) et doit, lors de l'apparition d'un essoufflement, réaliser des expirations longues afin de « chasser » le plus de CO2 possible. D'autre part ce phénomène d'essoufflement est largement aggravé par la profondeur, aggravation notamment liée aux pressions partielles. Un essoufflement à grande profondeur déclenche souvent une narcose associée, avec parfois perte de conscience, car l'augmentation de la ventilation pulmonaire provoquée par l'essoufflement provoque une augmentation très importante de la quantité de diazote absorbée.
Et enfin il existe une intoxication à l’azote qui est la narcose débutant dès 3,2 bars de pression partielle (soit 30 mètres de profondeur en respirant de l'air), et devient très dangereuse au-delà de 5,6 bars de pression partielle (60 mètres). Les réflexes s'amenuisent, l'esprit s'engourdit ; les facultés de jugement du plongeur sont altérées, au point de provoquer euphories, angoisses et comportements irraisonnés pouvant conduire à l'accident (on parle ainsi d'ivresse des profondeurs). C'est cette toxicité qui fixe la limite de pratique de la plongée à l'air à 60 mètres pour tous.
À plus grande profondeur, la perte de connaissance survient inévitablement. La diminution de la pression partielle du gaz narcotique entraine immédiatement la disparition de ces symptômes, sans autres séquelles (un plongeur narcosé peut ainsi se soustraire aux symptômes simplement en remontant de quelques mètres).
En profondeur, les problèmes sont différents et rendent la survie de l'être humain totalement impossible.
En profondeur
Les problèmes liés aux fonds marins sont nombreux et très contraignants.
Tout d'abord la faible voire la non présence d'oxygène dissout (créé par le mouvement de l'eau et la photosynthèse des plantes) dans les fonds marins qui rend tout d'abord la vie sous la mer impossible pour les êtres humains et difficile à partir d'une grande profondeur pour les organismes vivants.
Puis un des problèmes qui se pose est aussi l'absence de lumière à partir d'environ 200m. La photosynthèse est alors impossible, et par conséquentc la capacité à se nourrir aussi sauf pour les « fumeurs noirs » qui sont des bactéries qui vivent de souffre et de dioxyde de carbone (surnom donné car ces bactéries se nourrissent du souffre des Fumeurs Noir qui sont des volcans océaniques situés à grande profondeur à proximité des dorsales expulsant une eau très chaude qui semble noire à cause de la pression).
Cette bactérie appelée GSB1, profite de la faible lueur provoquée par les radiations géothermales. Mais celle-ci est trop faible pour être observée par l’œil humain mais est détectable dans le spectre de la lumière visible, au-delà de l’infrarouge.
Malgré l'absence de plantes entraînées par la photosynthèse on détecte tout de même un faible taux d'oxygène dissout et donc de la vie à plus de 1000m de profondeur !
En effet un écosystème s'est formé autour de ces fumeurs noirs : certains organismes extrêmophiles (être qui vit dans un milieu extrême) comme le riftia, un ver de 2m, fournissent les bactéries de souffre qui en retour nourrissent l'organisme : c'est la symbiose (l'association de deux organismes vivants d'espèces différentes qui cohabitent en en tirant un bénéfice mutuel).
L'absence de lumière entraîne un grand froid en profondeur (la moyenne de la température du fond de l'océan est d'environ 3°C sauf près des fumeurs où elle est de 330°C). La température change en fonction de la salinité mais reste sensiblement aux alentours de 0°C.
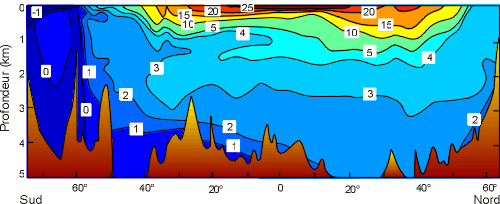
Exemple de distribution moyenne de la température sur une coupe de l'océan Atlantique Ouest.
On met en évidence 3 couches :
• la couche de surface (50-200m) où les températures avoisinent les températures de surface;
• la couche thermocline (200-1000 m) où les températures décroissent très rapidement (sauf aux grandes latitudes où elles sont déjà proches de celle des fonds);
• la zone profonde (jusqu'au fond) où les températures sont faibles et homogènes.
Enfin le dernier problème posé, et pas le moindre, est celui de la pression en profondeur.
En effet plus la profondeur augmente plus la pression est importante
La pression correspond à la poussée exercée par un fluide sur tout corps avec lequel il est en contact. Elle a pour unité le Pascal (1 Pa=10^-5 bar).
Au niveau de la mer, la pression atmosphérique est considérée à un bar mais il faut tenir compte du poids de l’eau au-dessus de nous. À 10m de profondeur, la pression due à l’eau est de 1kg/cm² c'est-à-dire d’un bar. Tous les 10m, la pression augmentera de nouveau d’un bar.
On identifie trois types de pression :
• La pression atmosphérique, qui est la pression exercée par une colonne d’air;
• La pression hydrostatique, qui est la pression exercée par une colonne de fluide;

Graphique de la pression hydrostatique selon la profondeur
http://www.google.com/patents/EP0188924A1?cl=fr
• La pression absolue, qui est l’addition de la pression atmosphérique et de la pression hydrostatique
À partir de 25m on trouve une pression de 3.5 bar (2.5bar pression hydrostatique+1bar pression atmosphérique), c’est la limite qu’un corps humain non entrainé peu supporter.
Il est donc impossible pour un être humain de survivre dans les grandes profondeurs.